全國(guó)加強(qiáng)第二類醫(yī)療器械注冊(cè)管理工作會(huì)議在成都召開(kāi)���。會(huì)議通報(bào)了境內(nèi)第二類醫(yī)療器械注冊(cè)清理規(guī)范及相關(guān)品種整改情況,就全面加強(qiáng)注冊(cè)管理有關(guān)工作作出部署���。國(guó)家藥監(jiān)局黨組成員�、副局長(zhǎng)徐景和出席會(huì)議并講話���。會(huì)議要求���,要全面強(qiáng)化境內(nèi)第二類醫(yī)療器械審評(píng)審批工作。要堅(jiān)持人民至上����,樹(shù)牢監(jiān)管為民理念;堅(jiān)持依法行政,嚴(yán)格規(guī)范審評(píng)審批��;堅(jiān)持源頭治理��,嚴(yán)格首個(gè)產(chǎn)品上市審批�;堅(jiān)持系統(tǒng)思維,加強(qiáng)質(zhì)量管理體系建設(shè)��,切實(shí)保障人民群眾用械安全��。

2021年12月�,湖南省藥監(jiān)局為規(guī)范醫(yī)療器械/體外診斷試劑注冊(cè)管理,組織制定第二類醫(yī)療器械/體外診斷試劑注冊(cè)業(yè)務(wù)流程�,自2022年1月1日起施行。和傳統(tǒng)流程相比時(shí)限縮短50%���。

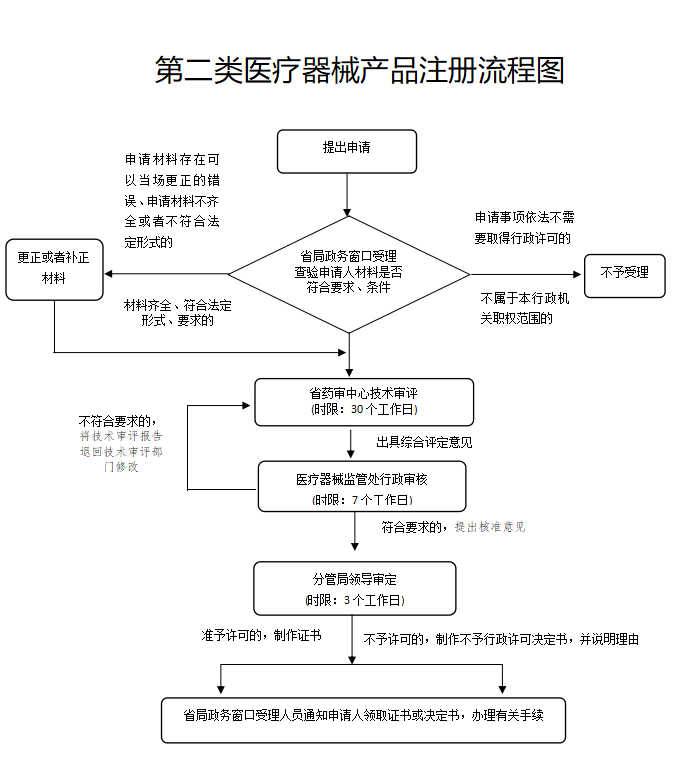
技術(shù)審評(píng)時(shí)限:僅為30個(gè)工作日����,包括發(fā)補(bǔ)審評(píng)�����。如果是特別快審只需要5個(gè)工作日���。
質(zhì)量管理體系核查:可以合并至生產(chǎn)許可現(xiàn)場(chǎng)檢查時(shí)進(jìn)行的�,也就是說(shuō)可以先拿注冊(cè)許可證,再進(jìn)行體系核查��。
行政審核時(shí)限:7個(gè)工作日�,快審只需要3個(gè)工作日。
行政審定時(shí)限:3個(gè)工作日(實(shí)施特別快速審批的為2個(gè)工作日)
制證時(shí)限:3個(gè)工作日(制證時(shí)限不計(jì)入總時(shí)限)
總時(shí)限:40個(gè)工作日(實(shí)施特別快速審批的為10個(gè)工作日��,不包含補(bǔ)充資料����、專家審評(píng)和體系核查時(shí)間)
法定時(shí)限:80個(gè)工作日
縮短時(shí)限:50%
2022年12月14日重慶市藥品技術(shù)審評(píng)查驗(yàn)中心和大渡口區(qū)大健康生物醫(yī)藥產(chǎn)業(yè)發(fā)展辦公室,發(fā)布通知���!決定在大渡口區(qū)試點(diǎn)開(kāi)展醫(yī)療器械產(chǎn)品注冊(cè)審評(píng)前置服務(wù)工作。據(jù)悉大渡口區(qū)醫(yī)療器械放管服服務(wù)中心(以下簡(jiǎn)稱“服務(wù)中心”)2名專員負(fù)責(zé)接件����,重慶市醫(yī)療器械技術(shù)審評(píng)查驗(yàn)服務(wù)站(以下簡(jiǎn)稱“服務(wù)站”)��,由市藥監(jiān)局統(tǒng)一調(diào)派5名技術(shù)審評(píng)專業(yè)人員入駐服務(wù)站���,為大渡口區(qū)第二類醫(yī)療器械注冊(cè)申請(qǐng)人��,根據(jù)相關(guān)服務(wù)內(nèi)容要求提供產(chǎn)品注冊(cè)審評(píng)前置服務(wù)。專業(yè)而充足的服務(wù)保障團(tuán)隊(duì),平均提升注冊(cè)時(shí)間3-4個(gè)月以上��,最快實(shí)現(xiàn)一周拿證���。
近些年隨著各省藥監(jiān)局陸續(xù)出臺(tái)了一系列優(yōu)化注冊(cè)流程���,縮短注冊(cè)時(shí)間的措施,并以此作為吸引IVD相關(guān)企業(yè)落戶及入駐園區(qū)�,這類措施有助于行業(yè)快速發(fā)展,但在一手提速度的時(shí)候��,一手也要把好質(zhì)量關(guān)��,堅(jiān)持系統(tǒng)思維�,加強(qiáng)質(zhì)量管理體系建設(shè),切實(shí)保障人民群眾用械安全��。
來(lái)源:IVD從業(yè)者網(wǎng)�����、國(guó)家藥監(jiān)局��,湖南省藥監(jiān)局���、重慶市藥品技術(shù)審評(píng)查驗(yàn)中心等